Препараты калия и магния в повседневной клинической практике
А. Кубынин, кандидат медицинских наук, СПбГМУ им. И.П. Павлова

Калий выполняет в организме важные и многообразные функции. По общему содержанию в клетке ионизированный калий является основным внутриклеточным катионом. Наряду с внеклеточным натрием, внутриклеточным магнием и рядом других ионов он участвует в формировании электрического потенциала клеточной мембраны и таким образом играет важную роль в первую очередь в генерации и проведении импульсов электровозбудимыми мембранами клеток нервной, мышечной и других тканей. Содержание калия в плазме крови в норме подвержено существенным колебаниям и составляет от 3,5 до 5,3 ммоль/л. При повышении содержания внеклеточного калия (в меньшей степени – при снижении содержания внутриклеточного калия) происходит пропорциональное снижение потенциала покоя (ПП), что может ускорять спонтанную деполяризацию мембраны. Снижение уровня калия в плазме крови, напротив, приводит к гиперполяризации мембран [4]. Калий участвует в образовании ацетилхолина, в синтезе белков, гликогена, секреции инсулина, регуляции мочевыделительной функции почек, энергетическом обмене и ряде других физиологических процессов. Это определяет его важность для функционирования самых разных тканей и органов, но особенно он важен для нормальной работы сердечнососудистой системы (ССС). В организме взрослого человека в зависимости от массы тела содержится от 150 до 250 г калия. При этом 98% калия на капливается в клетках и только 2% находится во внеклеточном пространстве. Важно отметить, что калий неравномерно распределен в тканях. Большая его часть, а точнее 75% от общего количества, содержится в мышечной ткани, тогда как, например, в костной ткани – лишь 7,5%. Потребность человека в калии достаточно высока – от 2 до 6 г/сут. При беременности и кормлении грудью, в растущем организме или при интенсивной физической работе потребность в калии возрастает. Калий поступает в организм с пищей – мясными продуктами, овощами и фруктами. Однако он легко выводится, преимущественно почками (около 90%), в меньшей степени – через желудочно-кишечный тракт (10%) и с потом (<1%). В организме отсутствуют механизмы, обеспечивающие удержание калия в дистальных канальцах почек. Поэтому выделение калия почками продолжается даже тогда, когда его поступление с пищей снижается, что приводит к усугублению дефицита калия в организме [2]. Снижение содержания К+ в организме может быть следствием недостаточного поступления калия с пищей при голодании, анорексии или парентеральном питании или результатом избыточных потерь калия. Значительные потери калия наблюдаются при неукротимой рвоте, хронической диарее, приеме тиазидных или петлевых диуретиков, при длительном лечении гидрокортизоном, болезнях почек на стадии полиурии, повышении уровня альдостерона в плазме – гиперальдостеронизме. Если вспомнить, что вторичный гиперальдостеронизм развивается при столь частых, к сожалению, сердечно-сосудистых заболеваниях (ССЗ), как гипертоническая болезнь и хроническая сердечная недостаточность, сопровождает развитие портальной гипертензии и хронической почечной недостаточности, становится понятной распространенность гипокалиемии в клинической практике. Так, уровень калия <3,6 ммоль/л выявляется более чем у 20% госпитализированных пациентов [19]. От 10 до 40% больных, принимающих тиазидные диуретики [23], и почти 50% пациентов, реанимированных после внегоспитальной фибрилляции желудочков [29], имеют низкий уровень калия. Проявления гипокалиемии в первую очередь определяются гиперполяризацией мембран нервных и мышечных клеток и как следствие – снижением их возбудимости. Это приводит к изменениям на ЭКГ и развитию ряда сердечных аритмий.
ЗНАЧЕНИЕ КАЛИЯ ДЛЯ ССС
Рассмотрим подробнее влияние калия на работу сердца. Электрическая активность клеток миокарда зависит от трансмембранных ионных градиентов, а также от время- и потенциалзависимых нарушений проведения ионных токов. Электролитные нарушения могут вызывать или облегчать развитие клинически значимых аритмий даже в условиях нормальной сердечной ткани путем модуляции проведения ионов через специфические ионные каналы миокарда. Ток Na+ в клетку при активации Na+-каналов формирует в кардиомиоцитах фазу быстрой деполяризации. По мере нарастания деполяризации проницаемость для Na+ падает вследствие инактивации Na+-каналов, но открываются каналы входящих токов Са++, которые необходимы для формирования фазы плато. Последующая активация калиевых каналов приводит к реполяризации мембраны кардиомиоцитов до уровня ПП. Калий, особенно внеклеточный, – самый важный фактор, определяющий ПП мембраны. Электрофизиологические эффекты калия зависят не только от его внеклеточной концентрации, но и от направленности (гипо- или гиперкалиемия) и скорости ее изменения. Первостепенное значение для регуляции трансмембранного градиента калия имеют калиевые ионные каналы. Калиевые каналы представляют собой трансмембранные белки, избирательно пропускающие ионы калия: калий движется под влиянием электрохимического градиента со скоростью от 106 до 108 ионов в секунду [1]. Существуют потенциалзависимые калиевые каналы и многочисленные каналы, открываемые для ионов калия или блокируемые различными веществами – лигандами соответствующих рецепторов. Такие каналы поддерживают фоновую проводимость мембран для ионов калия и формируют ПП возбудимых и невозбудимых клеток*. Гипокалиемия (<3 ммоль/л) снижает проницаемость мембран для калия [24]. Так, проводимость для входящего (аномального) калиевого тока выпрямления пропорциональна корню квадратному из величины внеклеточной концентрации калия [20, 21]. Зависимость активации задержанного (выходящего) тока выпрямления от внеклеточной концентрации калия помогает понять, почему длительность ПД меньше при высокой концентрации калия и больше – при низкой [31]. Но эффекты калия в отношении ПП мембраны модулируются и одновременно создаваемыми концентрациями Са++. Их взаимодействие таково, что повышенный уровень Cа++ снижает деполяризующий эффект, вызываемый повышенным уровнем калия. В свою очередь, низкий уровень Са++ ослабляет деполяризацию, вызываемую гипокалиемией.
Факторы, стимулирующие трансмембранное перемещение калия:
- из клетки во внеклеточное пространство:
– ацидоз;
– стимуляция α-адренорецепторов;
– препараты дигиталиса;
- из внеклеточного пространства в клетку:
– алкалоз;
– стимуляция β2-адренорецепторов;
– инсулин.
Повреждение фосфолипидов мембраны в процессах перекисного окисления липидов (ПОЛ) также приводит к нарушению барьерной функции мембраны и увеличению потерь калия клеткой. Активация ПОЛ происходит при таких патологических состояниях, как дистрофия, воспаление, ишемия миокарда и др.
ЭЛЕКТРОФИЗИОЛОГИЧЕСКИЕ ЭФФЕКТЫ ГИПОКАЛИЕМИИ
Гипокалиемия ведет к увеличению (большему электроотрицательному значению) ПП мембраны и по меньшей мере в период электрической диастолы снижает возбудимость мембран из-за увеличения разницы между ПП и пороговым потенциалом. Предполагается, что внеклеточный калий необходим для открытия каналов задержанного тока выпрямления [31]. Низкий уровень внеклеточного калия снижает задержанный (выходящий) ток калия, приводя к увеличению длительности ПД и замедлению реполяризации. Наиболее важным здесь является нарушение конфигурации ПД, особенно замедление «склона» 3-й фазы реполяризации. Формируется ПД с длинным «хвостом», что приводит к увеличению относительного рефрактерного периода (ОРП) и уменьшению разницы между ПП и пороговым потенциалом в конечную фазу ПД. Поэтому миокард демонстрирует повышенную возбудимость и связанную с этим склонность к эктопической активности в течение значительной части ПД. Проводимость замедляется, поскольку деполяризация начинается в неполностью реполяризованных волокнах. Более того, гипокалиемия приводит к удлинению фазы плато в волокнах Пуркинье, но укорачивает ее в вентрикулярных волокнах [10]. Фаза реполяризации («хвост») ПД в проводящей системе пролонгируется больше, чем в желудочках, что повышает разброс реполяризации. Гипокалиемия ускоряет диастолическую деполяризацию в волокнах Пуркинье, тем самым повышая автоматизм.
Суммарно электрофизиологические эффекты гипокалиемии проявляются в снижении скорости проведения, укорочении эффективного рефрактерного периода (ЭРП), удлинении ОРП, повышении автоматизма и ранней постдеполяризации.
ЭКГ-проявления гипокалиемии:
- вследствие изменений реполяризации:
– снижение амплитуды и расширение зубца Т;
– заметная волна U;
– снижение сегмента ST;
– слияние зубцов Т и U (при тяжелой гипокалиемии);
- вследствие нарушений проводимости:
– увеличение длительности комплекса QRS;
– атриовентрикулярная блокада;
– увеличение амплитуды и расширение зубца Р;
– небольшое увеличение интервала P–R;
– остановка сердца.
Когда волна U превышает зубец T по амплитуде, уровень калия в плазме составляет <3 ммоль/л (см. рисунок).
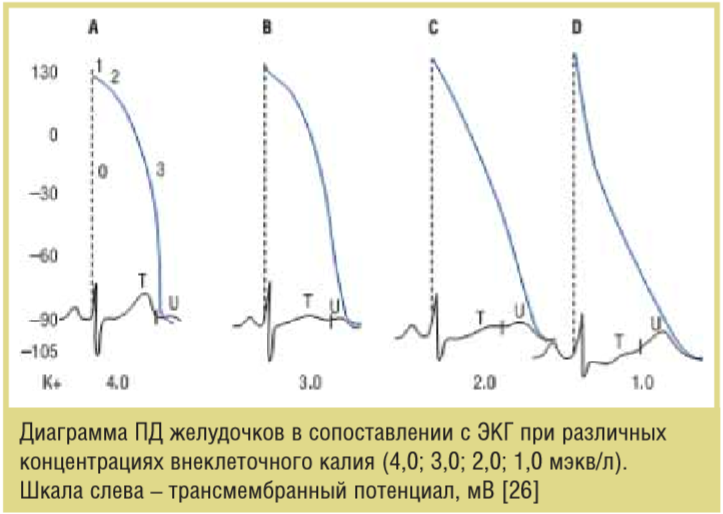
АРИТМОГЕННЫЙ ПОТЕНЦИАЛ И КЛИНИЧЕСКИЕ ПОСЛЕДСТВИЯ ГИПОКАЛИЕМИИ
Вызванное гипокалиемией повышение возбудимости клинически проявляется развитием суправентрикулярной и желудочковой экстрасистолии. Показано, что снижение уровня калия и магния коррелирует с повышением частоты преждевременных желудочковых комплексов [30]. Гипокалиемия способствует развитию феномена reentry (повторного входа) через замедление проводимости на фоне удлинения ОРП, что приводит к повышению разброса рефрактерности. Супрессивное влияние гипокалиемии на работу Na+-K+-насоса ведет к избыточному накоплению Ca++ в клетке, что способствует развитию замедленной постдеполяризации через транзиентный входящий ток. В эксперименте гипокалиемия повышала склонность к фибрилляции желудочков как в нормальном, так и в ишемизированном миокарде [12]. Установлена связь гипокалиемии с фибрилляцией желудочков у пациентов с острым инфарктом миокарда [7, 18]. Гипокалиемия способствует повышению связывания сердечных гликозидов с Na+-K+-аденозинтрифосфатазой (АТФазой), уменьшению скорости элиминации дигоксина и потенцирует токсические эффекты препаратов дигиталиса. Применяя препараты калия, необходимо помнить об одном важном феномене – эффекте Звардемакера–Либрехта (Zwaardemaker–Libbrecht), который развивается в результате быстрого повышения уровня внеклеточного калия от низкого к высокому и проявляет себя кратковременной остановкой пейсмейкерных клеток, уменьшением длительности ПД и гипреполяризацией [13]. Этот феномен подчеркивает тот факт, что скорость внутривенного введения калия с точки зрения аритмогенного действия важнее, чем абсолютное количество введенного калия и конечный уровень внеклеточного калия.
МАГНИЙ
Ионизированный магний стоит на 2-м месте после калия по общему содержанию в клетке. Содержание магния в плазме крови – 0,8–1,5 ммоль/л, в мышечной ткани его содержание в 10 раз больше, чем в плазме. Благодаря такому депо магния в мышцах его уровень в крови может долгое время оставаться стабильным даже при значительных потерях. Значимость нарушений обмена магния до сих пор дебатируется из-за трудностей его измерения и обычной связи этих нарушений с другими электролитными расстройствами [14, 27]. Магний участвует в работе мышц и нервной системы, в регуляции сердечного ритма, обмена холестерина, липидов, фосфора и кальция. Он служит важным кофактором для многочисленных ферментативных реакций, участвующих в обмене нуклеотидов и углеводов, синтезе белков и других процессах, также необходимых для нормальной физиологии ССС. Магний предупреждает повышение АД, усиливает процессы торможения в ЦНС, вызывая седативный, транквилизирующий эффекты и препятствуя проявлениям судорожной активности. Являясь естественным антагонистом Ca++, магний снижает свертываемость крови и тонус сосудов [2, 4]. Суточная потребность взрослого человека в магнии – от 300 до 500 мг. Дефицит магния развивается часто, но его электрофизиологические последствия для миокарда ускользают от ученых даже при самом тщательном исследовании. Известно, что применение препаратов магния (магнезии) в фармакологических дозах полезно для лечения пируэтных тахикардий. Токсические эффекты магнезии наблюдаются редко (исключение – пациенты с нарушениями функций почек). При дефиците магния развиваются нервозность, раздражительность, нарушения сна на фоне мышечной слабости, повышенной утомляемости и парестезий. При хроническом дефиците магния возможны деформации скелета: сколиоз, воронкообразная грудная клетка, плоскостопие.
ЭЛЕКТРОФИЗИОЛОГИЧЕСКИЕ ЭФФЕКТЫ И ЭКГ-ПРОЯВЛЕНИЯ ГИПОМАГНИЕМИИ
При очень низких внеклеточных концентрациях кальция магнезия оказывает влияние на трансмембранный ток или токи, которые модулируют длительность фазы плато ПД в желудочках. Установлено, что при нормальных концентрациях кальция дефицит магния имеет незначительное влияние на ПД папиллярной мышцы сердца собак [11]. Однако когда концентрация кальция снижается до 1/10 нормы, полное удаление магния из перфузионного раствора пролонгирует фазу плато ПД, которая уже была удлинена из-за низкой концентрации кальция, от нормальных значений (100–150 мс) до 1000 мс и более. Магний блокирует кальциевые каналы, смещает кривую инактивации быстрых натриевых каналов в направлении гиперполяризации, изменяет эффекты гиперкалиемии и оказывает модулирующее влияние на калиевые токи. В исследовании у здоровых пациентов были отмечены следующие ЭКГ-эффекты внутривенного введения магнезии: значимое удлинение интервала P–R; удлинение интервала проведения от предсердий к пучку Гиса; увеличение времени синоатриального проведения; удлинение ЭРП в атриовентрикулярном узле [16]. Гипермагниемия снижает атриовентрикулярную и внутрижелудочковую проводимость. Ни гипермагниемия, ни гипомагниемия не вызывают каких-либо специфических изменений ЭКГ. Внутривенное введение сульфата магнезии пациентам с увеличенным интервалом Q–T и пируэтной тахикардией, если исходный уровень магния был нормальным или низким, может купировать желудочковую тахикардию. О. Takanaka и соавт. [28] изучали действие магнезии и лидокаина на длительность ПД и индуцированную барием раннюю постдеполяризацию в волокнах Пуркинье собак. Полученные ими данные подтверждают, что гипомагниемия может иметь аритмогенное действие, когда сочетается с гипокалиемией и брадикардией; в этих условиях введение магнезии может подавить триггерную активность, главным образом прямо предупреждая развитие триггерных ПД. Не отмечено специфических электрофизиологических эффектов или аритмий, связанных с изолированным дефицитом магния. Тем не менее магний может повлиять на развитие сердечных аритмий через прямое воздействие или путем модулирования эффектов калия, или действуя в качестве блокатора кальциевых каналов. Известно, что дефицит магния оказывает негативное влияние на нормальное функционирование мембранной АТФазы, замедляя перенос натрия из клетки и калия в клетку. Это нарушает трансмембранное равновесие калия и может приводить к изменению ПП мембраны, изменению трансмембранной проводимости калия и нарушениям фазы реполяризации [9]. Приводятся данные о том, что потребление магния с пищей может иметь умеренную обратную корреляцию с риском развития ИБС, в частности, у мужчин [5].
ПРИМЕНЕНИЕ ПРЕПАРАТОВ КАЛИЯ И МАГНИЯ В КЛИНИЧЕСКОЙ ПРАКТИКЕ
Кратко резюмируя изложенное, необходимо сказать, что калий и магний играют важную роль в регуляции функций ССС и ЦНС, обеспечивают нормальное течение многочисленных обменных биохимических процессов практически во всех тканях и органах, регулируют нервно-мышечную передачу, положительно влияют на фосфорно-кальциевый обмен и поддерживают электролитный баланс в организме. Поэтому препараты этих макроэлементов могут и должны применяться по очень широкому кругу показаний – как в лечении разнообразных патологических состояний, так и с профилактической целью, в первую очередь – для предупреждения гипокалиемии и гипомагниемии у пациентов, принимающих мочегонные средства (тиазидные и, особенно, петлевые диуретики) и (или) сердечные гликозиды (препараты дигиталиса). В практической медицине используются препараты, содержащие один из этих элементов – калий (калия хлорид, калия оротат) или магний (Магне В6, магнерот, магнезии сульфат), а также комплексные препараты, содержащие оба катиона (аспарагинат калия + аспарагинат магния: Панангин, аспаркам, калия и магния аспарагинат БерлинХеми). В этом ряду одним из наиболее эффективных и сбалансированных по составу препаратов аспарагината калия и магния, солидный опыт успешного применения которого накоплен отечественной и мировой медицинской практикой, является Панангин. Сочетанное назначение солей калия и магния дает преимущество потенцирующего эффекта их взаимодействия. Такое сочетание тем более оправдано, что метаболизм калия и магния тесно связан и клинически значимая гипомагниемия обычно развивается на фоне гипокалиемии или осложняет уже имеющуюся гипокалиемию. Входящая в состав Панангина аспарагиновая кислота, являясь естественной аминокислотой, легко проникает в клетку и облегчает поступление в нее калия и магния. Она полезна еще и тем, что входит в состав многих белков, играет важную роль в обмене азотистых веществ, участвует в реакциях переаминирования и в образовании пиримидиновых оснований нуклеиновых кислот. Несмотря на реальные достижения медицинской науки в распознавании этиопатогенеза ССЗ, распространенность их неуклонно растет, они остаются ведущей причиной инвалидизации и смертности населения как в России, так и во всем мире. Поэтому наиболее актуальными показаниями к применению Панангина остаются такие заболевания, как хроническая сердечная недостаточность, ИБС, в том числе инфаркт миокарда, сердечные аритмии, особенно связанные с приемом препаратов дигиталиса, и их сочетания. Панангин является препаратом выбора в профилактике и восполнении дефицита калия и магния и в других клинических ситуациях. В перспективе показания к назначению Панангина будут расширяться. Накапливаются сведения о пользе применения калия и магния для лечения и профилактики нарушений мозгового кровообращения и гипертонической болезни. Так, замена обычной поваренной соли солью, обогащенной калием и магнием, у лиц с нормальным или умеренно повышенным АД привела к значимому снижению потребления натрия и снижению систолического АД [22]. В исследовании А. Ascherio и соавт., в которое были включены более 43 тыс. мужчин в возрасте от 40 до 75 лет, был обнаружен достоверно меньший относительный риск инсульта (0,62) у лиц с высоким потреблением калия (в среднем – 4,3 г/сут), чем у лиц с низким его потреблением (в среднем – 2,4 г/сут) [6]. Выявлена также обратная корреляция потребления магния (но не кальция) с относительным риском развития инсульта. Все указанные корреляции были сильнее выражены у мужчин с артериальной гипертензией, чем у нормотензивных лиц. Авторы заключили, что дополнительный прием препаратов калия может более широко использоваться у пациентов с артериальной гипертензией. Однако эти сведения не могут обосновать огульное назначение препаратов калия всем без разбора, поскольку их бесконтрольный прием может быть опасен. Сообщалось, что потребление магния с питьевой водой статистически значимо предупреждает вероятность смерти от цереброваскулярных заболеваний [32]. Как показало одно из проспективных исследований, повышение потребления калия на 10 ммоль/сут сопровождалось достоверным снижением риска смерти от инсульта на 40% [15]. Этот эффект не зависел от других факторов риска или переменных, включая потребление магния. Недавний метаанализ проспективных исследований обнаружил статистически значимую обратную корреляцию между потреблением калия и риском инсульта, особенно ишемического [17]. При повышении потребления калия на каждые 1000 мг риск инсульта снижался на 11%. Практически одновременно с этой работой в журнале американской коллегии кардиологов был опубликован другой метаанализ, в котором говорится о снижении риска инсульта на 21% на фоне приема препарата калия в суточной дозе 1,42 г и значимом снижении риска коронарных нарушений и сердечно-сосудистых осложнений в целом [8]. Препараты калия и магния находят применение и в хирургической анестезиологии. Р. Soave и соавт. сообщают, что применение магнезии в анестезиологической практике не только дает антиноцицептивный эффект благодаря блокаде NMDA-рецепторов и ассоциированных с ними каналов [33], но и необходимо для коррекции дефицита магния, который в чистом виде наблюдался у 7–11% госпитализированных пациентов, а в сочетании с другими электролитными нарушениями, особенно с гипокалиемией и гипофосфатемией, – у более чем 40% больных [25]. Восполнение дефицита магния в данном случае, по наблюдениям авторов, необходимо для предупреждения роста заболеваемости и смертности в послеоперационном периоде. Назначение калия и магния аспарагината особенно актуально при проведении операций на сердце и крупных сосудах, поскольку значимое снижение уровня калия и магния наблюдается также при экстракорпоральном кровообращении [3]. Если калия и магния аспарагинат не вводился предварительно, гипомагниемия развивалась у 50% пациентов. Таким образом, препараты калия и магния, в том числе Панангин, находят все более широкое применение в повседневной клинической практике.
1. Вислобоков А.И., Игнатов Ю.Д., Мельников К.Н. Фармакологическая регуляция ионных каналов мембраны нейронов / СПб.: Изд-во СПбГМУ. – 2006; 288 с.
2. Лесиовская Е.Е., Бахтина С.М., Бойко И.Н. Витамины, макро- и микро- элементы / СПб.: изд-во СПбХФА. – 2004; 140 с.
3. Трекова Н.А., Андрианова М.Ю., Толстова И.А., и др. Применение рас- твора калия и магния аспарагината для поддержания баланса калия и магния при кардиохирургических вмешательствах в условиях искусственного крово- обращения // Анестез. и реаниматол. – 2008; 5: 17–21.
4. Шестакова С.А., Долгодворов А.С., Кубынин А.Н. Нарушения водно- электролитного обмена и их фармакологическая коррекция / СПб.: Изд-во СПбГМУ. – 2005; 91 с.
5. Al-Delaimy W., Rimm E., Willett W. et al. Magnesium intake and risk of coronary heart disease among men // J. Am. Coll. Nutr. – 2004; 23 (1): 63–9.
6. Ascherio A., Rimm E., Hernan M. et al. Intake of potassium, magnesium, calcium, and fiber and risk of stroke among US men // Circulation. – 1998; 98: 1198–204.
7. Cooper W., Kuan P., Reuben S., Vanderburg M. Cardiac arrhythmias following acute myocardial infarction: Assosiation with serum potassium level and prior diuretic therapy // Eur. Heart J. – 1984; 5: 464–9.
8. D’Elia L., Barba G., Cappuccio F., Strazzullo P. Potassium intake stroke and cardiovascular disease. A meta-analisys of prospective studies // J. Am. Coll. Cardiol. – 2011; 57: 1210–19.
9. Dykcner T., Wester P. Relation between potassium, magnesiumand cardiac arrhythmias // Acta Med. Scand. Suppl. – 1981; 647: 163–9.
10. Gettes L., Surawicz B. Effects of low and high concentrations of potassium on the simultaneously recorded Purkinje and ventricular action potentials of the perfused pig moderator band // Circ. Res. – 1968; 23: 717–29.
11. Hoffman B., Suckling E. Effect of several cations on transmembrane potentials of cardiac muscle // Am. J. Physiol. – 1956; 186: 317–24.
12. Hohnloser S., Verrier R., Lown B., Reader E. Effect of hypokalemia on susceptibility to ventricular fibrillation in the normal and ishemic canine heart // Am. Heart J. – 1986; 112: 32–5.
13. Ito S., Surawicz B. Transient, «paradoxical» effects of increasing extracellular K+ -concentration on transmembrane potential in canine cardiac Purkinje fibers // Circ. Res. – 1977; 41: 799–807.
14. Keller P., Aronson R. The role of magnesium in cardiac arrhythmias // Prog. Cardiovasc. Dis. – 1990; 32: 433–48.
15. Khaw K., Barrett-Connor E. Dietary potassium and stroke-associated mortality. A 12-year prospective population study // N. Engl. J. Med. – 1987; 316: 235–40.
16. Kulick D., Hong R., Ryzen E. Electrophysiologic effects of intravenous magnesium in patients with normal conduction systems and no clinical evidence of significant cardiac disease // Am. Heart J. – 1988; 115: 367–73.
17. Larsson S., Orsini N., Wolk A. Dietary potassium intake and risk of stroke. A dose-response meta-analysis of prospective studies // Stroke. – 2011; 42 (10): 2746–50.
18. Nordrehaug J., Johanessen K., Von der Lippe G. Serum potassium concentration as a risk factor of ventricular arrhythmias early in acute myocardial infarction // Circulation. – 1985; 71: 645–49.
19. Paice B., Paterson K., Onyanga-Omara F. et al. Record linkage study of hypokaliemia in hospitalized patients // Postgrad. Med. J. – 1986; 62: 187–91.
20. Pelzer D., Trautwein W. Currents through ionic channels in multicellular cardiac tissue and single heart cells // Experentia. – 1987; 43: 1153–62.
21. Sakmann B., Trube G. Conductance properties of single inwardly rectifying potassium channels in ventricular cells from guinea pig heart // J. Physiol. – 1984; 347: 641–57.
22. Sarkkinen E., Kastarinen M., Niskanen T. et al. Feasibility and antihypertensive effect of replacing regular salt with mineral salt – rich in magnesium and potassium – in subjects with mildly elevated blood pressure // Nutr. J.– 2011; 10: 88.
23. Schulman M., Narins R. Hypokalemia and cardiovascular disease // Am. J. Cardiol. – 1990; 65: 4–9.
24. Sheu S., Korth M., Lathrop D.A. et al. Intra- and extra-cellular K+
and Na+ activities and resting membrane potential in sheep cardiac Purkinje strands // Circ. Res. – 1980; 47: 692–700.
25. Soave P.M., Conti G., Costa R., Arcangeli A. Magnesium and anaesthesia // Curr. Drug Targets. – 2009; 10 (8): 734–43.
26. Surawicz B. Relation between electrocardiogram and electrolites // Am. Heart J. – 1967; 73: 814–43.
27. Surawicz B., Lepeschkin E., Herrlich H. Low and high magnesiu concentrations at various calcium levels: Effect on the monophasic action potential, electrocardiogram and contractility of isolated rabbit hearts // Circ. Res. – 1961; 9: 811–8.
28. Takanaka C., Ogunyankin K., Sarma J., Singh B. Antiarrhythmic and arrhythmogenic actions of varying levels of extracellular magnesium: Possible cellular basis for the differences in the efficacy of magnesium and lidocaine in torsades de pointes // J. Cardiovasc. Pharmacol. Ther. – 1997; 2: 125–34.
29. Thompson R. Gobb L., Hypokalemia after resuscitation out-of-hospital ventricular fibrillation // JAMA. – 1982; 248: 2860–3.
30. Tsuji H., Venditti F., Evans J., et al. The assiciations of levels of serum potassium and magnesium with ventricular premature complexes (the Framingham Heart Study) // Am. J. Cardiol. (US). – 1994; 74: 232–5.
31. Yang T., Roden D. Extracellular potassium modulation of drug block of Ikr // Circulation. – 1996; 93: 407–11.
32. Yang C. Calcium and magnesium in drinking water and risk of death from cerebrovascular disease // Stroke. – 1998; 29: 411–4.
33. Zhu Y., Auerbach A. K+-occupancy of the n-methyl-d-aspartate receptor channel probed by Mg2+-block // J. Gen. Physiol. – 2001; 117(3): 287–98.