Коррекция дисбаланса макроэлементов при гипертонической болезни
И. Горбачева, доктор медицинских наук, профессор, Ю. Сычева, кандидат медицинских наук Первый СПбГМУ им. акад. И.П. Павлова

Гипертоническая болезнь (ГБ) остается одним из наиболее распространенных заболеваний сердечно-сосудистой системы и рассматривается как фактор риска возникновения другой сердечно-сосудистой патологии. В изучении механизмов патогенеза ГБ отмечается повышенное внимание к оценке роли электролитных расстройств. Особенно актуально изучение дисбаланса макроэлементов (избытка натрия и кальция, дефицита калия и магния [8]. Полагают, что наследственный фактор в развитии ГБ реализуется через генетически детерминированные дефекты трансмембранного переноса ионов, которые определяют рост содержания ионизированного кальция (Са2+) в цитозоле миоцитов стенки резистивных сосудов [7]. Нарушения трансмембранного переноса ионов ведут к задержке во внутренней среде натрия, росту преднагрузки сердца за счет увеличения сердечного выброса и устойчивому усилению спазма периферических сосудов, что служит причинами ГБ. Оба эти процесса являются Са2+-зависимыми. Сила сокращения сердца регулируется увеличением цитоплазматической концентрации Са2+ в кардиомиоцитах, а расслабление сосудов – удалением Са2+ из цитоплазмы клеток [2].
Повышенное содержание внутриклеточного Са обусловливает склонность к генерализованной вазоконстрикции. Рост содержания свободного Са в гладкомышечных элементах сосудистой стенки повышает степень сокращения и сократительную способность миоцитов стенки сосудов, что связывают с изменениями активности переноса Са через наружную и другие клеточные мембраны посредством функционирования Са2+-аденозинтрифосфатазы (АТФазы). Данная ионная помпа, которая выводит Са2+ в межклеточное пространство, представляет собой связанную с кальмодулином Са2+-АТФазу. Магний (Mg), являясь естественным антагонистом Са, участвует в процессах мембранного транспорта, способствует торможению сократительной активности гладких и поперечнополосатых мышц за счет расслабления отдельных клеток (миоцитов) путем блокады кальцийзависимого взаимодействия сократительных белков.
Среди всех катионов Mg занимает 4-е место по содержанию в организме человека (после калия – К, натрия – Na и Ca) и 2-е место (после К) по содержанию в клетке [4]. Магний, универсальный регулятор биохимических и физиологических процессов в организме, обеспечивает гидролиз АТФ, уменьшая разобщение окисления и фосфорилирование, регулирует гликолиз, уменьшает накопление лактата, способствует фиксации К в клетках, обеспечивая поляризацию клеточных мембран, контролирует спонтанную электрическую активность нервной ткани и проводящей системы сердца, контролирует нормальное функционирование кардиомиоцитов на всех уровнях субклеточных структур, в связи с чем является универсальным кардиопротектором [9].
Адекватный магниевый обмен нормализует деятельность мышцы сердца и его кровоснабжение, управляет процессами возбудимости и проводимости нервных элементов (нервная ткань, проводящая система сердца). Все энергетические процессы в организме проходят при обязательном участии Mg [5, 6, 11]. Согласно наблюдению [3], он оказывает сосудорасширяющее действие, способствует выведению холестерина, снижает свертываемость крови. Мg участвует в функционировании антиоксидантной системы, при его недостатке развивается первичное нарушение окислительно-восстановительных процессов в организме, что приводит к метаболическим сдвигам [1, 5, 6, 9, 10]. Таким образом, выявление артериальной гипертензии (АГ) уже подтверждает имеющийся тканевый или сывороточный дефицит Mg и является показанием для дополнительного введения данного макроэлемента [8]. Кроме того, традиционное лечение ГБ может вести к усугублению дефицита магния: длительное применение антагонистов Са способно снижать содержание Mg в эритроцитах и в сыворотке крови, применение диуретиков также приводит к гипомагниемии; в первую очередь речь идет о тиазидовых и тиазидоподобных препаратах (гидрохлортиазид, в меньшей степени индапамид) [8]. Целью исследования было повышение эффективности традиционной антигипертензивной терапии путем коррекции дисбаланса макроэлементов у больных ГБ. Для этого мы оценили особенности распределения патогенетически значимых макроэлементов Са, Na, Mg, K во вне- и внутриклеточных средах (на модели плазма – эритроциты крови) в сопоставлении с активностью свободнорадикального окисления; сопоставили степень корригируемости АД с особенностями дисбаланса макроэлементов, а также изучили динамику эффективности традиционной антигипертензивной терапии на фоне коррекции дисбаланса распределения макроэлементов в биологических средах.
Критериями включения пациентов в исследование были:
- возраст старше 18 лет;
- наличие ГБ II стадии. Из исследования исключали пациентов:
- перенесших в течение последних 6 мес инфаркт миокарда, нестабильную стенокардию, чреcкожные коронарные вмешательства, острое нарушение мозгового кровообращения, преходящее нарушение мозгового кровообращения;
- с вторичной гипертензией любой этиологии;
- с атриовентрикулярной блокадой II и III степени, фибрилляцией предсердий и другими видами аритмий, требующими лечения;
- с хронической сердечной недостаточностью (ХСН) I, II и IV ФК по NYHA;
- с почечной недостаточностью, стенозом обеих почечных артерий, после нефрэктомии;
- с декомпенсированным сахарным диабетом.
После подписания информированного согласия в исследование были включены 35 больных (15 мужчин и 20 женщин) в возрасте от 45 до 65 лет (средний возраст 55±10 лет). У всех пациентов была диагностирована ГБ II стадии. Больные получали антагонисты Са и мочегонные средства.
При обследовании всем больным повторно измеряли АД, исследовали состояние глазного дна, показатели липидного спектра крови, проводили электро- (ЭКГ) и эхокардиографию (ЭхоКГ), клинические анализы крови и мочи. Содержание макроэлементов (Ca, Mg, K, Na) в циркулирующей плазме крови и эритроцитах оценивали методом атомно-абсорбционной спектрометрии на аппарате ААС-1 (Германия). Активность свободнорадикального окисления белков оценивали по тиолдисульфидному отношению (ТДО) методом амперометрического титрования по В.В. Соколовскому (ТДO=SH/SS). У 20 пациентов с ГБ на фоне приема антигипертензивных препаратов отмечалась высокая клиническая эффективность с достижением целевого уровня АД (1-я группа). Во 2-ю группу вошли 10 (28,5%) больных ГБ II стадии, у которых АД на фоне лечения понизилось, однако окончательная его стабилизация не наступила; у больных сохранялись жалобы на периодическую головную боль и головокружение.
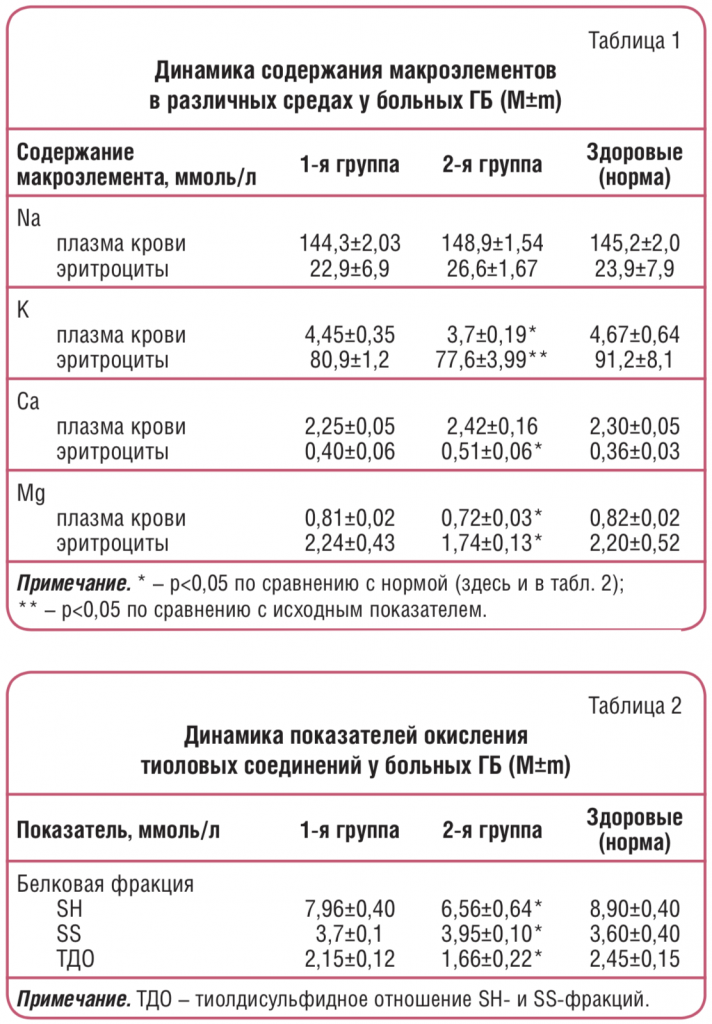
У больных 2-й группы ГБ (без стабилизации АД на фоне приема антагонистов Са и мочегонных средств) распределение макроэлементов в различных средах характеризовалось накоплением внутриклеточного Na и Са при достоверном дефиците K и Mg, в то время как в 1-й группе (со стабильным АД) отмечалось нормальное равновесие в распределении макроэлементов в биологических средах (табл. 1). В ходе исследования у больных установлено изменение показателей окисления тиолов. Признаком активности свободнорадикального окисления тиолов у больных 1-й группы явилась тенденция к снижению показателей восстановленной серы в составе белковых (SH) и небелковых (SS) фракций гемолизата крови на фоне повышения окисленной серы в составе SS-групп белков, однако достоверным изменение этих показателей было лишь во 2-й группе, т.е. у больных с дефицитом Mg (табл. 2). Изменения в данной системе в виде снижения ТДО позволяют предположить у больных, страдающих ГБ, развитие окислительного стресса. Инициирование в организме процессов свободнорадикального окисления сопряжено с функциональной недостаточностью обеспечения антиоксидантной защиты. Макроэлемент Mg участвует во многих метаболических реакциях по образованию, накоплению, переносу и утилизации энергии, свободных радикалов и продуктов их окисления; в работе отмечено увеличение активности перекисного окисления белков на фоне дефицита Mg.
Последний, возможно, снижает клиническую эффективность антигипертензивной терапии антагонистами Са, основной механизм действия которых заключается в том, что они тормозят проникновение Са2+ из межклеточного пространства в мышечные клетки сердца и сосудов через медленные кальциевые каналы L-типа. Снижая концентрацию Ca2+ в кардиомиоцитах и клетках гладкой мускулатуры сосудов, они расширяют коронарные артерии и периферические артерии и артериолы, оказывают выраженное сосудорасширяющее действие. При дефиците Mg нарушаются процессы мембранного транспорта Ca и повышается его содержание внутри клетки, что тормозит расслабление сосудов. Установленные закономерности, выявляющие нарушения минерального баланса, послужили основанием для назначения больным 2-й группы (с ГБ II стадии без стабилизации АД на фоне приема антагонистов Са и мочегонных препаратов) заместительной терапии с использованием Панангина – препарата, содержащего аспарагиновые соли магния и калия. Медикаментозную коррекцию дефицита Mg и К больным проводили с помощью курсового лечения Панангином (по 1 драже 3 раза в день в течение 4 нед). Присоединение препаратов, содержащих Mg, к стандартной антигипертензивной терапии антагонистами Са и мочегонными усиливало эффективность действия антигипертензивных средств и приводило к отчетливому клиническому улучшению состояния больных и стабилизации АД. Уменьшение головокружения отметили 5 (50%) обследованных, головной боли – 8 (80%). По истечении указанных сроков больные проходили контрольное обследование (табл. 3).
Лечение Панангином проводилось под контролем не только распределения макроэлементов (К, Na, Mg, Ca) в плазме крови и внутриклеточных средах, но и перекисного окисления белков. Применение Панангина и коррекция дефицита Mg оптимизировали антирадикальную защиту белков (табл. 4).
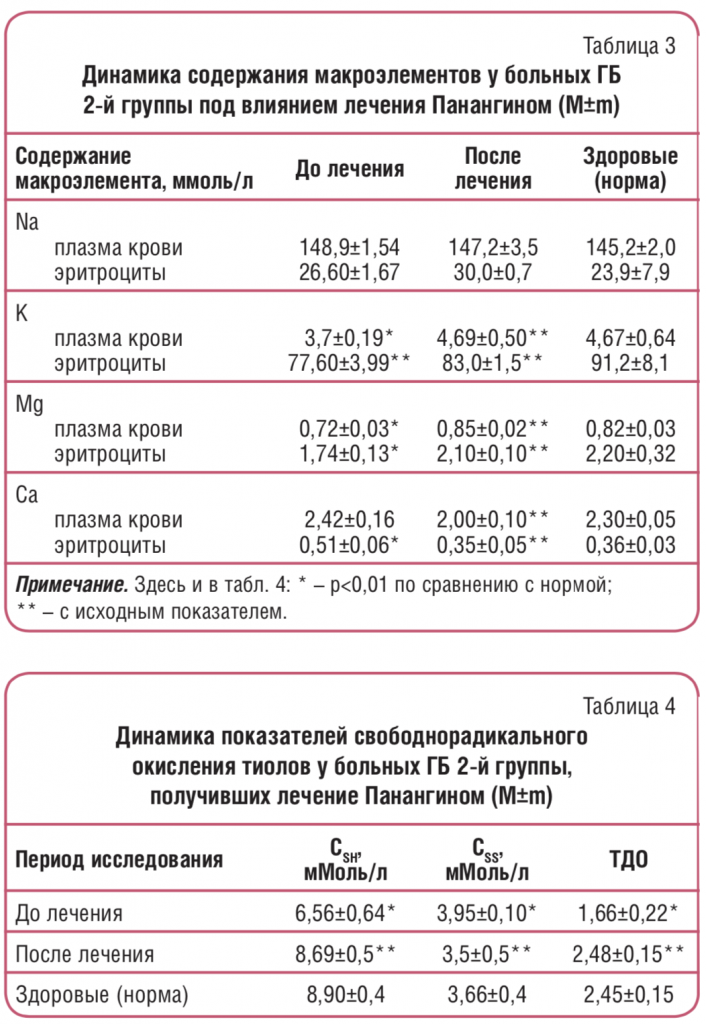
При восполнении дефицита Mg не только уменьшалась интенсивность окисления белковой серы с образованием SS-групп, но и увеличивались ресурсы восстановленной серы, готовой к противоокислительной защите молекул белков. Возможно, это связано с активизацией ферментных систем, мобилизирующих восстановленную серу из ее депо в системе низкомолекулярных тиолов, главным образом – унитиола.
1. Акарачкова Е.С. Применение Магне В6 в терапевтической практике // Трудный пациент. – 2007; 5: 48–54.
2. Беликова Н. А. Активность Са2+-АТФазы плазматических мембран лимфоцитов больных первичной артериальной гипертензией. Автореф. ... дис. ... канд. биол. наук. М., 2003; 147 с.
3. Буданова М.В., Асланова П.А., Буданов П.В. Клинические проявления и эффекты коррекции дефицита магния у детей // Трудный пациент. – 2009; 7 (1–2): 50–4.
4. Бурчинский С.Г. Проблема дефицита магния в организме: методы фар- макологической коррекции // Здоровье Украины. – 2004; 103: 5–6.
5. Горбачева И.А., Орехова Л.Ю., Сычева Ю.А. и др. Воспалительные забо- левания пародонта в полиморбидном континууме, интегративный подход к лечению / СПб.: Издательство ООО «АСпринт», 2012; 140 с.
6. Горбачева И.А., Шестакова Л.А., Шабак-Спасский П.С. и др. Роль вос- становления клеточного баланса калия и магния в коррекции функционально- го состояния гладкомышечного аппарата у больных с дискинетическими рас- стройствами органов пищеварения // Ученые записки. – 2012; 19 (3): 92–5.
7. Постнов Ю.В. О роли кальциевой перегрузки митохондрий и энергетического дефицита в патогенезе первичной артериальной гипертензии // Арх. патол. – 2001; 3: 3–10.
8. Садовникова И.И. Электролитный дисбаланс при сердечно-сосудистых заболеваниях – коррекция необходима! // Рус. мед. журн. – 2007; 15 (9): 782–4.
9. Шилов А.М., Авшалумов А.Ш., Марковский В.Б. и др. Взаимосвязь дефицита магния и метаболический синдром // Рус. мед. журн. – 2009; 17 (8): 576–82.
10. Cernak I., Savic V., Kotur J. et al. Alterations in magnesium and oxidative status during chronic emotional stress // Magnes. Res. – 2000; 3: 34–45.
11. Iezhitsa I. Potassium and magnesium depletions in congestive heart failure- pathophysiology, consequences and replenishment // Clin. Calcium. – 2005; 15 (11): 123–33.
12. Peacock J., Ohira Т. Serum Magnesium and Risk of Sudden Cardiac Death in the Atherosclerosis Risk in Communities (ARIC) Study // Am. Heart J. – 2010; 160 (3): 464–70.
13.Ueshima K. Magnesium and ischemic heart disease: a review of epidemiological, experimental, and clinical evidences // Magnes. Res. – 2005; 18 (4): 275–84. CORRECTION OF MACROELEMENT IMBALANCE IN HYPERTENSIVE DISEASE I. Gorbacheva, Yu. Sycheva Acad. I.P. Pavlov First Saint Petersburg State Medical University Panangin compensation for magnesium deficiency developing in arterial hypertension enhances the efficacy of standard antihypertensive drugs, improves patients’ status, and stabilizes blood pressure. Key words: hypertensive disease, magnesium deficiency, Panangin.